Betalactámicos
Betalactámicos (Penicilinas)
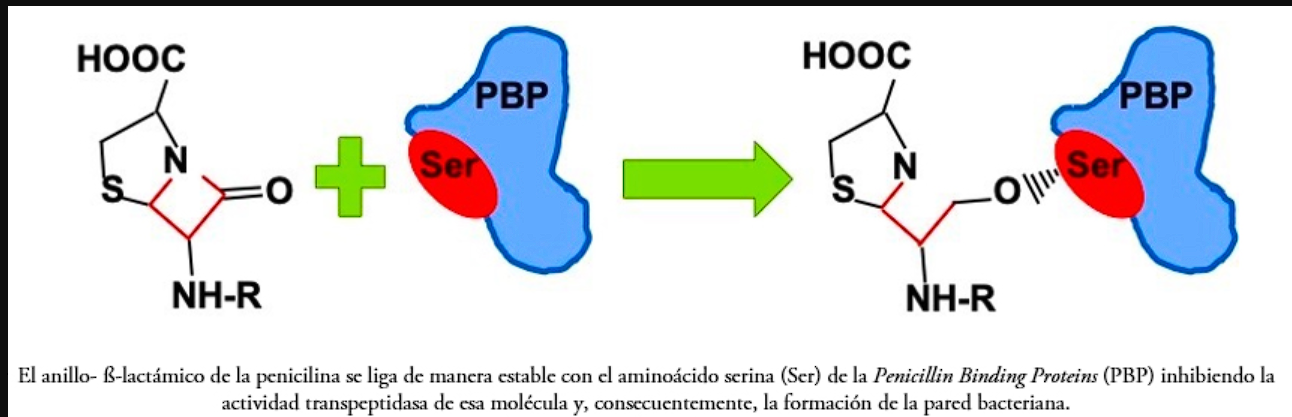
Figura 1. Unión de la penicilina a la serina del sitio activo de las PBPs
MECANISMO DE ACCIÓN PENICILINA:
La penicilina (y otros β-lactámicos) actúa uniéndose a la serina del sitio activo de las PBPs de S. pneumoniae.
-
Esto bloquea la transpeptidación (formación de enlaces cruzados en el peptidoglicano), debilitando la pared celular y provocando lisis bacteriana.
La resistencia a cefalosporinas en Streptococcus pneumoniae ha aumentado en las últimas décadas, afectando la eficacia de antibióticos como ceftriaxona, cefotaxima y otras cefalosporinas de tercera generación.
Resistencia
Los antibióticos betalactámicos inhiben competitivamente las enzimas transpeptidasas, cuya función es entrelazar las grandes moléculas de peptidoglucano para formar una estructura rígida en forma de un estuche que protege a la célula bacteriana de los cambios extremos de osmolaridad en el medio extracelular, estas enzimas reciben el nombre de PBP, del inglés penicillin-binding proteins. La inhibición competitiva de las enzimas PBPs por los betalactámicos ocurre debido a que estos antibióticos son similares, espacialmente, al sustrato natural de la enzima PBP, este sustrato es un pentapéptido que termina en los aminoácidos D-alanina-D-alanina. En S. pneumoniae se han descrito 6 PBPs (1a, 1b, 2a, 2b, 2x, 3), alteraciones en las PBPs (2x, 2b, y 1a, adquiridas fundamentalmente por transformación), y son responsables de la resistencia a todos los betalactámicos. Es importante conocer que en el proceso de adquisición de resistencia, conjuntamente con la reducción de la afinidad de las PBPs por los antibióticos betalactámicos, estas enzimas también reducen su afinidad por su sustrato natural. Consecuentemente con este fenómeno, el germen resistente puede formar un peptidoglucano con un menor grado de estructuración, lo que le resta competencia biológica.
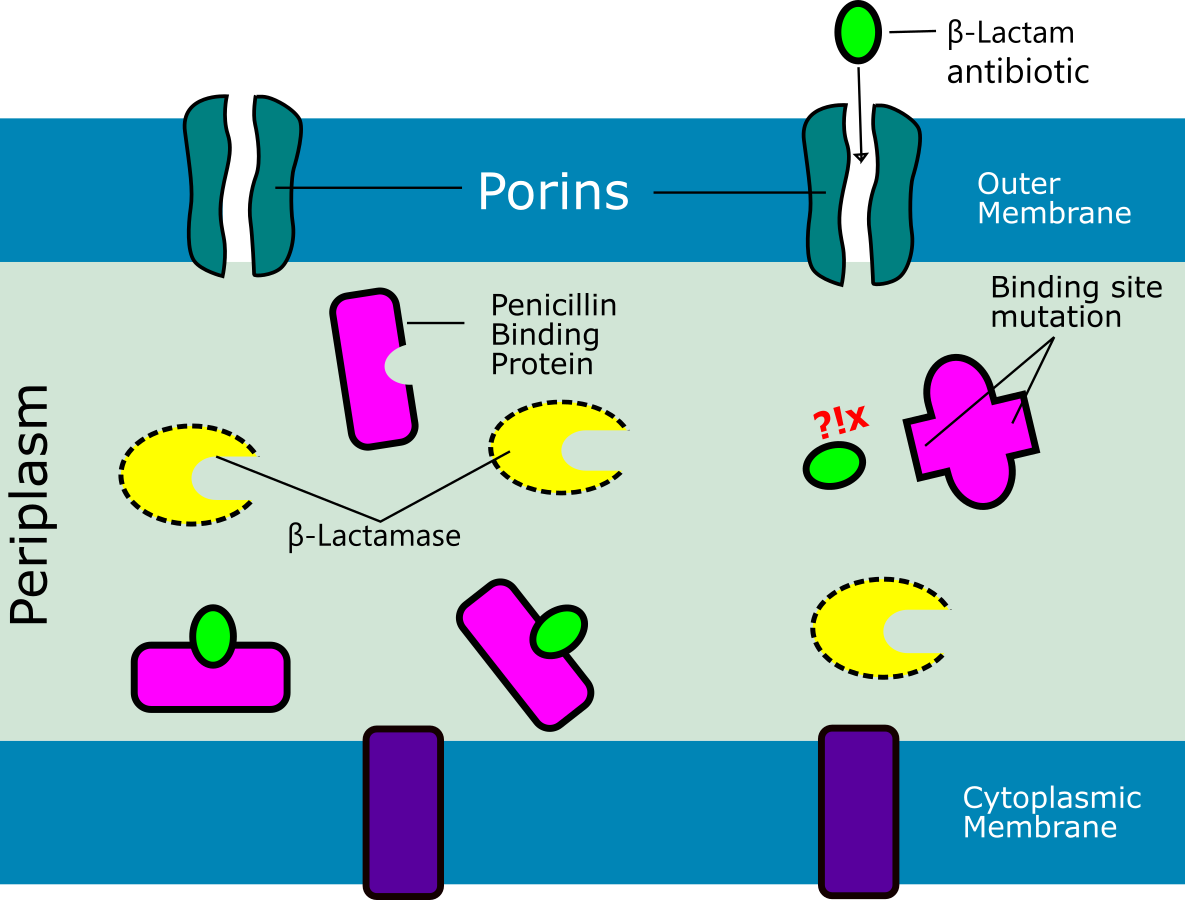
Figura 2. Mecanismo de resistencia a antibióticos betalactámicos por mutación de las proteínas de unión a la penicilina (PBPs)
Vías de Administración
La penicilina G sódica o potásica se administra por vía intravenosa continua o intermitente o por inyección intramuscular. Las compuestas de procaína y de benzatina se administran por vía intramuscular (IM) solamente. La penicilina G potásica es susceptible a la destrucción por el ácido gástrico, y por lo tanto, cuando se requiere un tratamiento oral, se utilizan la penicilina V o la amoxicilina, que tienen una mayor biodisponibilidad oral.
Susceptibilidad antibiótica
Susceptibilidad a penicilinas.
La resistencia a penicilina y a los otros b lactámicos en S. pneumoniae es debida a modificaciones en las PBPs, lo que produce una menor afinidad entre estas proteínas y el agente antimicrobiano.
Un enfoque muy práctico es usar un disco de oxacilina de 1 µg para deducir la susceptibilidad a penicilina. Si la zona de inhibición en rededor al disco de oxacilina es > 20 mm, la cepa es considerada susceptible a penicilina y se puede informar como tal. Si el área de inhibición es < 19 mm esa cepa debe ser estudiada por un método cuantitativo de CIM para clarificar si es susceptible, tiene susceptibilidad intermedia o es resistente a penicilina, ya que un pequeño porcentaje de cepas tendrá un área < 19 mm pero puede todavía ser susceptible.
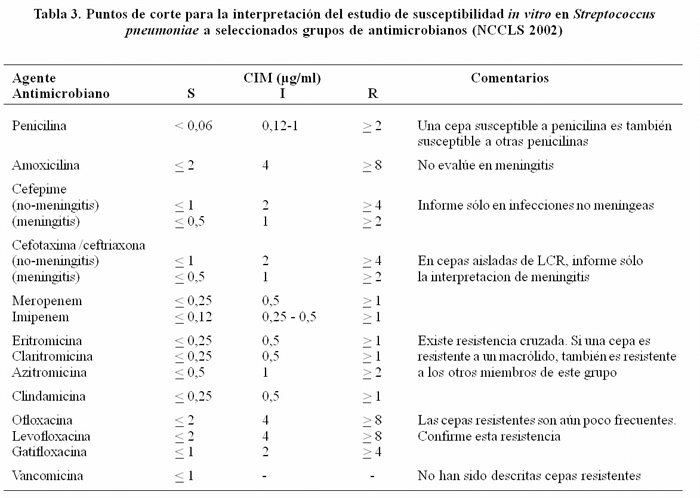
Los puntos de corte para definir susceptibilidad y resistencia de S. pneumoniae a penicilina por CIM siguen siendo los mismos: una cepa con CIM de < 0,06 µg/ml es susceptible, con CIM de 0,12 a 1,0 es intermedia y con una CIM de > 2 µg/ml es considerada resistente a penicilina. Si un neumococo es susceptible a penicilina, debe ser considerado susceptible también a otras penicilinas.
Con respecto a amoxicilina, el NCCLS cambió en enero del 2000 los puntos de corte, basado en nueva información relativa a farmaco-dinamia y farmacocinética de este agente. La amoxicilina sólo puede ser estudiada por un método de CIM y no debe ser evaluada si la cepa ha sido aislada de LCR en un paciente con meningitis, ya que estos puntos de corte son para infecciones respiratorias. Los nuevos puntos de corte son: CIM de < 2 µg/ml indica susceptibilidad, CIM de 4 µg/ml indica susceptibilidad intermedia y CIM de > a 8 µg/ml es considerada resistente. En consecuencia, cepas de neumococos que presentan susceptibilidad intermedia o resistencia a penicilina pueden ser todavía susceptibles a amoxicilina. Además, si un neumococo es aislado de un paciente con neumonía y presenta susceptibilidad intermedia a penicilina, puede ser tratado aún con penicilina, usando dosis altas de este agente.
Susceptibilidad a cefalosporinas.
Como comentáramos anteriormente, la resistencia a cefalosporinas es producida también por modificaciones de las PBPs que se encuentran en la pared celular del neumococo. Las cefalosporinas de tercera generación son muy eficaces en el tratamiento de infecciones producidas por S. pneumoniae, estos agentes deben ser estudiados e informados en todas las cepas aisladas de LCR. Este año el NCCLS ha incluido puntos de corte diferentes dependiendo de si la cepa ha sido aislada de un paciente con meningitis o no. Las cefalosporinas que tienen estos nuevos puntos de corte son: ceftriaxona, cefotaxima y cefepime. Sin embargo, es necesario tener en cuenta que cefepime no ha sido autorizado aún por la FDA para el tratamiento de meningitis causadas por S. pneumoniae resistente; por esto en la actualidad, el NCCLS recomienda informarlo sólo en aquellas infecciones no meníngeas.
Algunas de las cefalosporinas orales no alcanzan concentraciones suficientemente altas en el sitio de infección para inhibir cepas causantes de infecciones respiratorias con susceptibilidad intermedia o resistentes a penicilina. No existe hasta este momento una estandarización ni tampoco puntos de corte para estudiar las cefalosporinas mediante el método de difusión por disco y por lo tanto, estos agentes no deben ser estudiado por este método
Equipo de Redacción de IQB Editor: Alvaro Galiano. (s. f.). PENICILINA G EN VADEMECUM. https://www.iqb.es/cbasicas/farma/farma04/b008.htm
Noda Albelo, Amauri, Vidal Tallet, Lázaro Arturo, Vidal Tallet, Joan Iavier, & Hernández Álvarez, Leanet. (2011). Streptococcus pneumoniae, mecanismos de resistencia antimicrobiana. Revista Cubana de Pediatría, 83(3), 288-295. Recuperado en 22 de abril de 2025, de https://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75312011000300008&lng=es&tlng=es.
Hakenbeck R, Brückner R, Denapaite D, Maurer P. Mecanismos moleculares de la resistencia a los β-lactámicos en Streptococcus pneumoniae. Microbiol del futuro. Marzo de 2012; 7(3):395-410. doi: 10.2217/fmb.12.2. PMID: 22393892.
Palavecino R., Elizabeth. (2002). Puesta al día en el estudio de susceptibilidad de Streptococcus pneumoniae. Revista chilena de infectología, 19(Supl. 2), 101-106. https://dx.doi.org/10.4067/S0716-10182002019200007
Sodik, JJ, Mulyani, Y. Mutación de la proteína de unión a la penicilina y más allá: un enfoque integral para abordar la resistencia a Streptococcus pneumoniae. Ciencias de la Farmacia. 2023; 2(1):37-45.

